Da igual que sea un móvil, un portátil, la Nintendo Switch o una Dyson: conforme lo vayas usando, la autonomía de la batería se va a ir reduciendo. Sí, las baterías de ion litio han cambiado el mundo y desde hace años son el estándar absoluto en electrónica de consumo, pero la degradación con el paso del tiempo es su mal endémico. Mientras buscamos alternativas a esta tecnología, un equipo de investigación ha encontrado una solución prometedora en una aparentemente simple ajuste químico.
El avance. La idea principal de esta investigación no es cambiar los materiales principales de la batería, sino simplemente añadir una pequeña cantidad de un aditivo: el difluorofosfato de litio. Su existencia no es nueva, pero esta investigación liderada por el profesor Chunsheng Wang de la Universidad de Maryland revela lo eficaz que es para estabilizar las baterías.
Por qué es importante. Porque las baterías de ion litio están presentes en todas partes y esta modificación permitiría prolongar su vida útil utilizando una química estándar y de bajo coste. El resultado de su experimento es que con este aditivo se puede optimizar las baterías para maximizar potencia y energía, o bien para lograr una mayor vida útil y estabilidad.
A efectos prácticos, el estudio evidencia cómo con este ajuste mantuvieron una capacidad significativamente mayor después de cientos de ciclos de carga y descarga. Como explica Wang, "Es una modificación relativamente sencilla de las baterías actuales". O lo que es lo mismo, después de haber ejecutado pruebas de seguridad y ciclos prolongados, "podría llegar de forma realista a los consumidores".
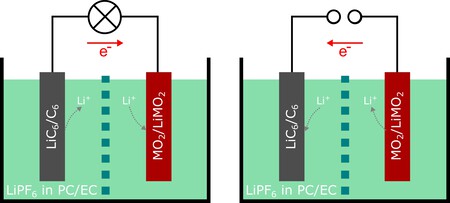
Breves apuntes del mecanismo de una pila. Las baterías de iones litio están conformadas por un ánodo negativo y un cátodo positivo y tienen un separador poroso entre ambas. El conjunto está sumergido en un electrolito cuya misión es permitir que los iones de litio se muevan entre electrodos durante la carga y descarga.
Con la descarga, el ánodo libera electrones al circuito eléctrico (da electricidad al dispositivo) e iones al electrolito, reencontrándose en el cátodo. Con la carga, una fuente externa (el cargador) invierte el proceso "bombeando" los iones de vuelta al ánodo para almacenar la energía en la estructura química. La degradación de su capacidad con el uso se produce por la pérdida irreversible del litio en reacciones químicas secundarias y por la fatiga mecánica de los electrodos.
En detalle. Si profundizamos un poco más en la explicación anterior, aparece la interfase de electrólito sólido (SEI), una capa delgada que se forma en el ánodo durante las primeras cargas. En las baterías estándar, esta capa es frágil y se rompe con el uso, consumiendo litio y reduciendo la vida útil de la batería.
Mediante una reacción sencilla inspirada en la química orgánica, este aditivo hace que el electrolito sea más propenso a aceptar electrones, haciendo que la degradación esté más controlada. En pocas palabras, ayuda a formar una SEI más robusta, elástica y uniforme, actuando así como una suerte de escudo que evita que el electrolito reaccione de forma parásita con los electrodos. Además, es una química flexible que puede ajustarse para que sea más o menos protectora y la presencia del aditivo minimiza la presencia de grietas en el cátodo.
En Xataka | China vendió baterías baratas durante años. El problema es que entre tanto nadie construyó una alternativa
Portada | John Cameron
-
La noticia El gran problema de las baterías de ion litio es su degradación con el paso del tiempo. Un ajuste químico puede cambiarlo fue publicada originalmente en Xataka por Eva R. de Luis .
☞ El artículo completo original de Eva R. de Luis lo puedes ver aquí